Thuốc Tagrisso 80mg được chỉ định điều trị cho bệnh nhân trưởng thành ung thư phổi không phải tế bào nhỏ.
1. Thuốc Tagrisso 80mg là thuốc gì?
Thuốc Tagrisso 80mg thuộc nhóm thuốc chống ung thư
Osimertinib là chất ức chế Tyrosine Kinase (TKI). Đây là chất ức chế không thuận nghịch thụ thể yếu tố phát triển biểu bì (Epidermal Growth Factor Receptors - EGFRs) có đột biến nhạy cảm (EGFRm) và đột biến T790M đề kháng với TKI.\
Thuốc Tagrisso 80mg được chỉ định điều trị cho bệnh nhân trưởng thành ung thư phổi không phải tế bào nhỏ
2. Thành phần thuốc Tagrisso 80mg
Thành phần mỗi viên chứa:
Osimertinib ………………………….. 80mg
Tá dược
Tá dược với tác dụng đã biết: Thuốc có chứa 0,6 mg natri trong mỗi viên 80 mg.
Nhân viên: mannitol, microcrystalline cellulose, low-substituted hydroxypropyl cellulose, sodium stearyl fumarate.
Lớp bao: polyvinyl alcohol, titanium dioxide (E 171), macrogol 3350, talc, oxide sắt vàng (E 172), oxide sắt đỏ (E 172), oxide sắt đen (E 172).
3. Dạng bào chế
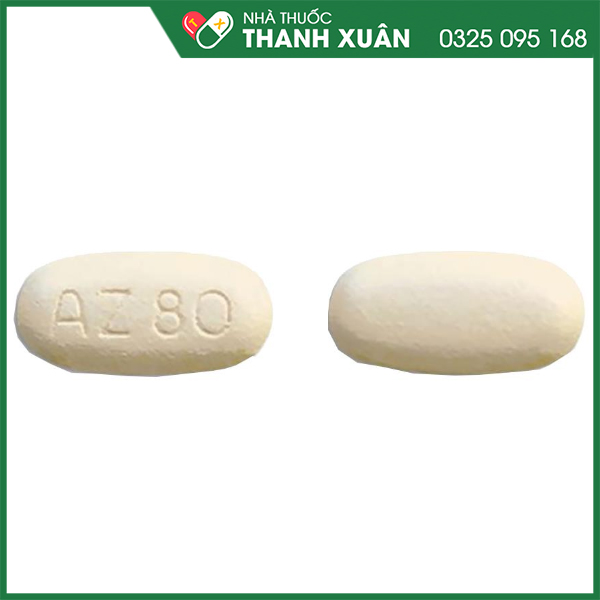
Thuốc Tagrisso 80mg được bào chế dưới dạng viên nén bao phim, viên màu be, hình bầu dục, kích thước 7,25 x 14,5mm, hai mặt lồi, có khắc “AZ” và “80” ở một mặt và một mặt trơn.
4. Chỉ định
Thuốc Tagrisso 80mg đơn trị liệu được chỉ định cho:
- Điều trị bước 1 ở bệnh nhân trưởng thành ung thư phổi loại không tế bào nhỏ (NSCLC) giai đoạn tiến triển tại chỗ hoặc di căn có đột biến hoạt hóa thụ thể yếu tố phát triển biểu bì (EGFR).
- Điều trị bệnh nhân trưởng thành ung thư phổi loại không tế bào nhỏ (NSCLC) giai đoạn tiến triển tại chỗ hoặc di căn có đột biến EGFR T790M dương tính.
5. Liều dùng và cách dùng thuốc
Liều dùng
Điều trị bằng Tagrisso nên được bắt đầu với bác sĩ có kinh nghiệm trong trị liệu kháng ung thư.
Khi xem xét dùng Tagrisso, tình trạng đột biến EGFR trong mẫu khối u hoặc huyết tương nên được xác định bằng phương pháp xét nghiệm đã được công nhận (xem phần Cảnh báo và thận trọng).
Liều lượng
Liều khuyến cáo là 80 mg osimertinib, 1 lần/ngày cho đến khi bệnh tiến triển trở lại hoặc xuất hiện độc tính phản ứng ngoại ý không thể chấp nhận.
Nếu quên 1 liều Tagrisso, nên uống thuốc ngay trừ phi liều kế tiếp sẽ được dùng trong vòng 12 giờ.
Tagrisso có thể uống kèm hoặc không kèm thức ăn tại cùng một thời điểm mỗi ngày.
Điều chỉnh liều
Có thể cần ngưng liều và/hoặc điều chỉnh liều dựa trên mức độ an toàn và dung nạp của mỗi cá nhân. Nếu cần giảm liều, nên giảm xuống liều 40 mg, 1 lần/ngày.
Hướng dẫn giảm liều khi gặp độc tính phản ứng ngoại ý được trình bày trong Bảng 6.
- xem Bảng 6.
Các nhóm bệnh nhân đặc biệt
Không cần chỉnh liều do tuổi, cân nặng, giới tính, chủng tộc hoặc tình trạng hút thuốc của bệnh nhân (xem phần Đặc tính dược động học).
Bệnh nhân suy gan
Dựa trên các nghiên cứu lâm sàng, không cần điều chỉnh liều ở bệnh nhân suy gan nhẹ (Child Pugh A) hoặc suy gan trung bình (Child Pugh B). Tương tự, dựa vào phân tích trên dân số đánh giá dược động học, không cần điều chỉnh liều ở bệnh nhân suy gan nhẹ (tổng bilirubin ≤ giới hạn trên của mức bình thường (ULN) và men aspartate aminotransferase (AST) >ULN hoặc tổng bilirubin >1,0 đến 1,5x ULN và xuất hiện AST) hoặc ở bệnh nhân suy gan trung bình (tổng bilirubin từ 1,5 đến 3 lần ULN và có xuất hiện AST). Hiệu quả và tính an toàn của thuốc chưa được thiết lập trên bệnh nhân suy gan nặng. Cho đến khi có dữ liệu mới, không khuyến cáo dùng trên bệnh nhân suy gan nặng (xem phần Đặc tính dược động học).
Bệnh nhân suy thận
Dựa vào các nghiên cứu lâm sàng và phân tích trên dân số đánh giá dược động học, không cần chỉnh liều ở bệnh nhân suy thận nhẹ, trung bình hoặc nặng. Tính an toàn và hiệu quả của thuốc chưa được thiết lập ở bệnh nhân bệnh thận giai đoạn cuối [độ thanh thải creatinin (CLcr) thấp hơn 15 mL/phút được tính theo công thức Cockcroft and Gault] hoặc đang lọc máu. Nên thận trọng khi điều trị cho bệnh nhân suy thận nặng và bệnh thận giai đoạn cuối (xem phần Đặc tính dược động học).
Trẻ em
Tính an toàn và hiệu quả của Tagrisso ở trẻ em và trẻ vị thành niên <18 tuổi chưa được thiết lập. Hiện chưa có dữ liệu.
Cách dùng
Thuốc dùng đường uống. Nuốt nguyên viên với nước và không được nghiền, bẻ hoặc nhai.
Trường hợp bệnh nhân không thể nuốt nguyên viên thuốc, có thể phân tán viên thuốc trong 50mL nước không chứa carbonate. Thả nguyên viên thuốc vào nước, không được nghiền, khuấy đều cho đến khi thuốc phân tán và uống dịch thuốc ngay lập tức. Nên dùng thêm nửa ly nước tráng ly để đảm bảo không còn cặn thuốc và uống ngay. Không dùng thêm bất kỳ chất lỏng nào khác.
Nếu cần dùng qua đường ống thông dạ dày, nên theo quy trình như trên nhưng lượng nước dùng sẽ là 15ml ở lần pha đầu và 15ml khi tráng cặn. Tổng hợp 30ml chất lỏng sẽ được dùng theo hướng dẫn của nhà sản xuất ống thông dạ dày với lượng nước tráng ống thông (water flushes). Nên dùng dịch phân tán và tráng cặn trong vòng 30 phút kể từ khi thuốc được pha vào nước.
6. Chống chỉ định
Quá mẫn với hoạt chất hoặc bất kỳ tá dược nào liệt kê tại phần Mô tả - Thành phần tá dược.
Thuốc St. John's Wort không nên dùng chung với Tagrisso (xem phần Tương tác).
7. Tác dụng không mong muốn của thuốc
Tóm tắt dữ liệu an toàn thuốc
Các nghiên cứu trên bệnh nhân ung thư phổi không tế bào nhỏ (NSCLC) có đột biến EGFR dương tính
Dữ liệu đề cập dưới đây phản ánh việc tiếp xúc với thuốc Tagrisso trên 1142 bệnh nhân ung thư phổi loại không phải tế bào nhỏ (NSCLC) có đột biến EGFR dương tính. Các bệnh nhân này đã được điều trị với TAGRISSO liều 80mg mỗi ngày trong hai nghiên cứu ngẫu nhiên pha 3 (FLAURA, bước 1 và AURA 3, bước 2), hai nghiên cứu đơn nhánh (AURAex và AURA2, bước 2 hoặc lớn hơn) và một nghiên cứu pha 1 (AURA1, bước 1 hoặc lớn hơn) (xem phần Đặc tính dược lực học). Đa số các phản ứng ngoại ý ở cấp độ 1 hoặc 2. Các phản ứng ngoại ý thường gặp nhất được ghi nhận là tiêu chảy (49%) và nổi mẫn (47%). Các phản ứng ngoại ý cấp độ 3 và 4 trong các nghiên cứu này chiếm tỷ lệ tương ứng là 9,7% và 0,9%. Việc giảm liều do ADR xảy ra chiếm tỷ lệ 2,1% trên tổng số bệnh nhân đang dùng Tagrisso 80mg, 1 lần/ngày. Ngưng thuốc do gặp phản ứng ngoại ý chiếm tỷ lệ 4,3%.
Bệnh nhân có tiền sử bệnh phổi mô kẽ (ILD), đã dùng thuốc gây ILD, viêm phổi do xạ trị phải dùng steroid, hoặc có bất kỳ bằng chứng ILD tiến triển trên lâm sàng đã được loại trừ khỏi các nghiên cứu lâm sàng này. Bệnh nhân có bất thường về nhịp và dẫn truyền quan trọng trên lâm sàng được xác định bằng ECG lúc nghỉ (ví dụ khoảng QTc lớn hơn 470 mili giây) đã được loại trừ. Bệnh nhân được đánh giá LVEF khi tầm soát và mỗi 12 tuần theo dõi sau đó.
Bảng phân loại phản ứng ngoại ý
Các phản ứng ngoại ý được ấn định theo nhóm tần suất xảy ra tại Bảng 7 dựa trên tỷ lệ báo cáo phản ứng ngoại ý trong dữ liệu gộp từ 1142 bệnh nhân ung thư phổi loại không tế bào nhỏ có đột biến EGFR dương tính được điều trị với TAGRISSO liều 80mg mỗi ngày trong các nghiên cứu FLAURA, AURA3, AURAex, AURA2 và AURA1.
Các phản ứng ngoại ý do thuốc được liệt kê theo nhóm hệ cơ quan (SOC) trong MedDRA. Trên mỗi nhóm hệ cơ quan, các phản ứng ngoại ý được xếp hạng dựa theo tần suất xảy ra với các phản ứng xảy ra thường xuyên nhất được liệt kê đầu tiên. Trong mỗi nhóm tần suất, phản ứng ngoại ý được liệt kê theo mức nghiêm trọng giảm dần. Ngoài ra, phân loại tần suất tương ứng cho mỗi ADR được dựa trên quy ước CIOMS III và định nghĩa như sau: rất thường gặp (≥1/10); thường gặp (≥1/100 - <1/10); không thường gặp (≥1/1.000 - <1/100); hiếm gặp (≥1/10.000 - <1/1.000); rất hiếm (<1/10.000); chưa rõ (không thể dự đoán từ dữ liệu sẵn có).
- xem Bảng 7.
Các phát hiện về tính an toàn trong các nghiên cứu một nhánh pha 2 AURAex và AURA2 nhìn chung đồng nhất với những quan sát trên nhánh dùng Tagrisso của nghiên cứu AURA3. Không ghi nhận có độc tính khác hoặc bất ngờ và các biến cố ngoại ý là tương tự về loại, mức độ nghiêm trọng và tần số.
Mô tả một số phản ứng ngoại ý chọn lọc
Bệnh phổi mô kẽ (ILD)
Trong các nghiên cứu FLAURA và AURA, tần xuất xảy ra ILD là 10,4% ở bệnh nhân Nhật Bản, 1,8% ở bệnh nhân Châu Á không phải người Nhật Bản và 2,8% ở nhóm không phải bệnh nhân Châu Á. Thời gian trung vị khởi phát ILD hoặc phản ứng ngoại ý giống ILD là 85 ngày (xem phần Cảnh báo và thận trọng).
Khoảng QTc kéo dài
Trên 1142 bệnh nhân trong các nghiên cứu FLAURA và AURA điều trị bằng Tagrisso 80mg, có 0,9% số bệnh nhân (n=10) được phát hiện có khoảng QTc >500 mili giây, và 3,6% số bệnh nhân (n=41) có khoảng QTc >60 mili giây so với trị số ban đầu. Một phân tích dược động học/dược lực học với Tagrisso đã dự báo nguy cơ gia tăng khoảng QTc kéo dài phụ thuộc vào liều. Không ghi nhận biến cố loạn nhịp liên quan đến QTc trong các nghiên cứu FLAURA và AURA (xem phần Cảnh báo và thận trọng và Đặc tính dược lực học).
Ảnh hưởng trên dạ dày-ruột
Trong nghiên cứu FLAURA và AURA, tiêu chảy được báo cáo ở 49% bệnh nhân trong đó 39% ở cấp độ 1, 8,0% cấp độ 2 và 1,2% ở cấp độ 3; không có báo cáo ở cấp độ 4 hoặc 5. Có 0,2% bệnh nhân được yêu cầu giảm liều và 1,4% bệnh nhân được yêu cầu ngưng thuốc tạm thời. Một biến cố (0,1%) dẫn đến ngưng điều trị. Trong nghiên cứu FLAURA và AURA3, thời gian trung vị khởi phát tương ứng là 19 ngày và 22 ngày và thời gian trung vị của biến cố cấp độ 2 tương ứng 19 ngày và là 6 ngày.
Biến cố huyết học
Việc giảm sớm số lượng trung vị bạch cầu, bạch cầu lympho, bạch cầu trung tính và tiểu cầu trên xét nghiệm đã được quan sát thấy ở những bệnh nhân điều trị bằng Tagrisso, số lượng này ổn định theo thời gian và sau đó vẫn duy trì trên giới hạn dưới của mức bình thường. Các biến cố ngoại ý liên quan đến giảm bạch cầu, giảm bạch cầu lympho, giảm bạch cầu trung tính và giảm tiểu cầu đã được báo cáo, hầu hết trong số đó là ở mức độ nhẹ hoặc trung bình và không dẫn đến ngưng thuốc.
Người cao tuổi
Trong nghiên cứu FLAURA và AURA3 (N=1142), có 43% số bệnh nhân ở độ tuổi ≥65 tuổi, và 13% bệnh nhân ≥75 tuổi. Tỷ lệ phản ứng ngoại ý dẫn đến chỉnh liều thuốc nghiên cứu (ngưng thuốc hoặc giảm liều) được ghi nhận nhiều hơn ở bệnh nhân ≥65 tuổi so với nhóm bệnh nhân trẻ hơn (<65) (13,4% so với 7,6%). Loại phản ứng ngoại ý là tương tự nhau bất kể tuổi tác. Bệnh nhân cao tuổi gặp nhiều phản ứng ngoại ý cấp độ 3 hoặc cao hơn so với nhóm bệnh nhân trẻ tuổi hơn (13,4% so với 9,3%). Không ghi nhận có sự khác biệt về hiệu quả của thuốc giữa nhóm bệnh nhân cao tuổi này và nhóm trẻ tuổi hơn. Một kết quả tương tự về tính an toàn và hiệu quả cũng được quan sát thấy khi phân tích các nghiên cứu AURA pha 2.
Bệnh nhân có thể trọng thấp
Bệnh nhân điều trị với Tagrisso 80mg có thể trọng thấp (<50kg) ghi nhận xảy ra với tần suất cao hơn về các biến cố ngoại ý cấp độ ≥3 (52% so với 35%) và khoảng QTc kéo dài (14% so với 4%) so với bệnh nhân có thể trọng cao (≥50kg).
Báo cáo phản ứng ngoại ý nghi ngờ do thuốc
Báo cáo các phản ứng ngoại ý nghi ngờ do thuốc sau khi thuốc được cấp phép lưu hành là quan trọng. Điều này cho phép tiếp tục theo dõi sự cân bằng giữa nguy cơ/lợi ích của thuốc. Cán bộ y tế được yêu cầu báo cáo bất kỳ tác dụng không mong muốn nào qua hệ thống báo cáo quốc gia.
Chú ý “Thông báo cho bác sĩ những tác dụng không mong muốn gặp phải khi sử dụng thuốc.
8. Tương tác thuốc
Tương tác về dược động học
Các thuốc cảm ứng CYP3A4 mạnh có thể làm giảm nồng độ và thời gian tiếp xúc của osimertinib. Osimertinib có thể làm tăng nồng độ và thời gian tiếp xúc của chất nền protein kháng ung thư vú (BCRP) và P-glycoprotein (P-gp).
Hoạt chất có thể làm tăng nồng độ osimertinib trong huyết tương
Các nghiên cứu in vitro đã cho thấy osimertinib được chuyển hóa pha I chủ yếu qua CYP3A4 và CYP3A5. Trong một nghiên cứu dược động học trên lâm sàng, khi dùng chung với 200 mg itraconazole (chất ức chế CYP3A4 mạnh) x 2 lần/ngày đã không ảnh hưởng đáng kể về lâm sàng trên nồng độ và thời gian tiếp xúc với osimertinib (diện tích dưới đường cong (AUC) tăng 24% và Cmax giảm 20%). Vì vậy, chất ức chế CYP3A4 có lẽ không ảnh hưởng đến nồng độ và thời gian tiếp xúc của osimertinib. Chưa xác định được các men xúc tác thêm.
Hoạt chất có thể làm giảm nồng độ osimertinib trong huyết tương
Trong một nghiên cứu dược động học lâm sàng trên bệnh nhân, diện tích nồng độ osimertinib dưới đường cong ở giai đoạn ổn định (AUC steady state) giảm 78% khi dùng chung với rifampicin (600mg/ngày trong 21 ngày). Tương tự, nồng độ và thời gian tiếp xúc với chất chuyển hóa AZ5104 cũng giảm 82% (đối với trị số AUC) và 78% (đối với trị số Cmax). Khuyến cáo nên tránh dùng Tagrisso đồng thời với các chất cảm ứng CYP3A mạnh (như phenytoin, rifampicin và carbamazepin). Các chất cảm ứng CYP3A4 trung bình (như bosentan, efavirenz, etravirine, modafinil) có thể cũng làm giảm nồng độ và thời gian tiếp xúc osimertinib và nên sử dụng thận trọng hoặc tránh dùng nếu có thể. Chưa có dữ liệu lâm sàng để khuyến cáo chỉnh liều Tagrisso. Chống chỉ định dùng chung với thuốc St. John's Wort (xem phần Chống chỉ định).
Ảnh hưởng của các thuốc làm giảm dịch dạ dày trên osimertinib
Trong một nghiên cứu dược động học lâm sàng, việc dùng đồng thời với omeprazole đã không thay đổi nồng độ và thời gian tiếp xúc của osimertinib trên lâm sàng. Các chất điều biến pH dịch vị có thể dùng chung với Tagrisso mà không có bất kỳ hạn chế nào.
Hoạt chất có nồng độ trong huyết tương có thể thay đổi do Tagrisso
Theo các nghiên cứu in vitro, osimertinib là chất ức chế cạnh tranh của chất vận chuyển BCRP.
Trong một nghiên cứu dược động học trên lâm sàng, khi dùng đồng thời Tagrisso với rosuvastatin (chất nền nhạy cảm BCRP) sẽ làm tăng AUC và Cmax của rosuvastatin tương ứng là 35% và 72%. Ở bệnh nhân đang dùng đồng thời với các thuốc có khuynh hướng phụ thuộc BCRP và có chỉ số điều trị thấp, nên theo dõi chặt chẽ về dấu hiệu thay đổi tính dung nạp của thuốc dùng chung vì có thể là kết quả của sự tăng nồng độ và thời gian tiếp xúc trong khi dùng chung với Tagrisso (xem phần Đặc tính dược động học).
Trong một nghiên cứu dược động học trên lâm sàng, việc dùng đồng thời Tagrisso với simvastatin (chất nền nhạy cảm CYP3A4) sẽ làm giảm AUC và Cmax của simvastatin tương ứng là 9% và 23%. Các thay đổi này nhỏ và có lẽ là không đáng kể về mặt lâm sàng. Không chắc xảy ra tương tác dược động học trên lâm sàng với chất nền CYP3A4. Không loại bỏ nguy cơ giảm nồng độ và thời gian tiếp xúc của hormon ngừa thai khi dùng đồng thời.
Trong một nghiên cứu lâm sàng về tương tác thuốc của thụ thể Pregnane X (PXR), sử dụng đồng thời Tagrisso với fexofenadine (chất nền P-gp) đã làm tăng AUC và Cmax của fexofenadine tương ứng là 56% (90% CI 35, 79) và 76% (90% CI 49, 108) sau khi dùng một liều duy nhất, và 27% (90% CI 11, 46) và 25% (90% CI 6, 48) khi ở trạng thái ổn định. Bệnh nhân dùng đồng thời với các thuốc phụ thuộc P-gp và có ngưỡng trị liệu hẹp (như digoxin, dabigatran, aliskiren) nên được theo dõi chặt chẽ các dấu hiệu thay đổi khả năng dung nạp do tăng mức tiếp xúc của thuốc dùng đồng thời với Tagrisso
9. Cảnh báo và thận trọng khi dùng thuốc Tagrisso 80mg
Thận trọng
Đánh giá tình trạng đột biến EGFR
Khi xem xét dùng Tagrisso để điều trị cho bệnh nhân ung thư phổi loại không phải tế bào nhỏ (NSCLC) giai đoạn tiến triển tại chỗ hoặc di căn, việc xác định tình trạng đột biến EGFR dương tính là rất quan trọng. Nên thực hiện một xét nghiệm đã được công nhận bằng cách sử dụng mẫu DNA khối u lấy từ mẫu mô hoặc mẫu DNA khối u trong hệ tuần hoàn (ctDNA) thu thập từ mẫu huyết tương.
Chỉ dùng các phương pháp xét nghiệm có độ tái lập, độ tin cậy, độ nhạy cùng với tính ứng dụng (utility) đã được kiểm chứng để xác định tình trạng đột biến EGFR của mẫu DNA khối u (từ mẫu mô hoặc mẫu huyết tương).
Việc xác định tình trạng dương tính của đột biến EGFR sử dụng xét nghiệm trên mẫu mô hoặc mẫu huyết tương sẽ cho biết có đủ điều kiện điều trị với Tagrisso. Tuy nhiên, nếu sử dụng xét nghiệm mẫu DNA khối u trong hệ tuần hoàn dựa trên mẫu huyết tương và có kết quả âm tính, khuyến cáo nên theo dõi tiếp bằng xét nghiệm từ mẫu mô nếu có thể vì có khả năng xét nghiệm mẫu huyết tương cho kết quả âm tính giả.
Bệnh phổi mô kẽ (ILD)
Bệnh phổi mô kẽ (ILD) trầm trọng/đe dọa đến tính mạng/gây tử vong hoặc phản ứng ngoại ý giống ILD (như viêm phổi không do nhiễm trùng) đã được ghi nhận ở bệnh nhân dùng Tagrisso trong các nghiên cứu lâm sàng. Hầu hết các trường hợp được cải thiện hoặc biến mất khi ngưng điều trị. Bệnh nhân có tiền sử ILD trước đây, đã dùng thuốc gây ILD, viêm phổi do xạ trị mà yêu cầu dùng steroid hoặc có bất kỳ bằng chứng ILD tiến triển trên lâm sàng đã được loại trừ khỏi các nghiên cứu lâm sàng này (xem phần Tác dụng không mong muốn).
Đã ghi nhận bệnh phổi mô kẽ (ILD) hoặc phản ứng ngoại ý giống ILD (như viêm phổi không do nhiễm trùng) ở 3,9% bệnh nhân và tử vong ở 0,4% trên tổng số 1142 bệnh nhân dùng Tagrisso trong các nghiên cứu FLAURA và AURA. Tần xuất xảy ra ILD là 10,4% ở bệnh nhân là người Nhật bản, 1,8% ở bệnh nhân Châu Á và 2,8% ở nhóm bệnh nhân không thuộc chủng tộc Châu Á (xem phần Tác dụng không mong muốn).
Cần đánh giá thận trọng để loại trừ ILD đối với tất cả bệnh nhân khởi phát cấp tính triệu chứng đường hô hấp (khó thở, ho, sốt) và/hoặc các triệu chứng này trở nên nặng hơn không giải thích được. Nên ngưng điều trị bằng thuốc này trong khi đang kiểm tra các triệu chứng trên. Nếu đã chẩn đoán là ILD, nên ngưng Tagrisso và bắt đầu các liệu pháp điều trị cần thiết. Việc sử dụng lại Tagrisso chỉ nên được xem xét sau khi cân nhắc cẩn thận lợi ích và nguy cơ của từng bệnh nhân.
Hội chứng Stevens-Johnson
Các báo cáo ca lâm sàng của hội chứng Stevens-Johnson (SJS) hiếm khi được ghi nhận liên quan đến điều trị Tagrisso. Trước khi bắt đầu điều trị, bệnh nhân nên được thông báo về các dấu hiệu và triệu chứng của hội chứng SJS. Nếu xuất hiện các dấu hiệu và triệu chứng gợi ý về hội chứng SJS, nên ngưng tạm thời hoặc ngừng Tagrisso ngay lập tức.
Kéo dài khoảng QTc
Khoảng QTc kéo dài xuất hiện trên bệnh nhân dùng Tagrisso và có thể dẫn đến tăng nguy cơ nhịp nhanh thất (như xoắn đỉnh) hoặc tử vong đột ngột. Không có biến cố loạn nhịp nào được ghi nhận trong các nghiên cứu FLAURA hoặc AURA (xem phần Tác dụng không mong muốn). Bệnh nhân có bất thường về nhịp và dẫn truyền nặng trên lâm sàng khi đo điện tâm đồ lúc nghỉ (ECG) (như là khoảng QTc lớn hơn 470 mili giây) đã được loại trừ trong các nghiên cứu này (xem phần Tác dụng không mong muốn).
Khi có thể, nên tránh dùng osimertinib trên bệnh nhân có hội chứng QT kéo dài bẩm sinh. Nên theo dõi định kỳ điện tâm đồ (ECGs) và chất điện giải trên bệnh nhân suy tim sung huyết, rối loạn điện giải hoặc ở bệnh nhân đang dùng thuốc đã biết làm kéo dài khoảng QTc. Nên ngưng điều trị ở bệnh nhân có khoảng QTc lớn hơn 500 mili giây được ghi nhận trên ít nhất 2 lần đo điện tâm đồ tách biệt cho đến khi khoảng QTc nhỏ hơn 481 mili giây hoặc phục hồi về trị số căn bản nếu khoảng QTc lớn hơn hoặc bằng 481 mili giây, sau đó có thể dùng lại Tagrisso ở mức liều giảm như trình bày tại Bảng 6. Nên ngưng osimertinib vĩnh viễn ở bệnh nhân có khoảng QTc kéo dài đi kèm với các biến cố sau: xoắn đỉnh, nhịp nhanh thất đa dạng, có dấu hiệu/triệu chứng loạn nhịp trầm trọng.
Thay đổi tính co thắt cơ tim
Trong các nghiên cứu lâm sàng, phân suất tống máu thất trái (Left Ventricular Ejection Fraction - LVEF) giảm ≥10% và một sự sụt giảm <50% đã xảy ra trong 3,9% (35/908) bệnh nhân dùng Tagrisso, là những người có đánh giá LVEF khi khởi đầu điều trị và tối thiểu 1 lần theo dõi sau đó. Trên bệnh nhân có các yếu tố nguy cơ trên tim và những người có các tình trạng có thể ảnh hưởng đến LVEF, nên xem xét theo dõi tim, bao gồm đánh giá LVEF khi khởi đầu (at baseline) và trong khi điều trị. Trên bệnh nhân có dấu hiệu/triệu chứng tim liên quan trong khi điều trị, việc theo dõi tim bao gồm đánh giá LVEF nên được xem xét.
Viêm giác mạc
Viêm giác mạc đã được ghi nhận ở 0,7% (n=8) trên tổng số 1142 bệnh nhân điều trị bằng Tagrisso trong các nghiên cứu FLAURA và AURA. Nên thăm khám bác sỹ chuyên khoa mắt ngay lập tức khi bệnh nhân có các dấu hiệu và triệu chứng nghi ngờ viêm kết mạc như tình trạng cấp hoặc trầm trọng hơn của viêm mắt, chảy nước mắt, nhạy cảm ánh sáng, mờ mắt, đau mắt và/hoặc mắt đỏ (xem phần Liều lượng và Cách dùng - Bảng 6).
Độ tuổi và cân nặng
Bệnh nhân cao tuổi (>65 tuổi) hoặc bệnh nhân có thể trọng thấp (<50kg) có thể tăng nguy cơ phát triển các tác dụng không mong muốn Độ 3 hoặc cao hơn. Nên theo dõi chặt chẽ ở những bệnh nhân này (xem phần Tác dụng không mong muốn).
Natri
Thuốc này chứa <1 mmol natri (23 mg) trong mỗi viên 40 mg hoặc 80 mg, do vậy có thể xem như là thuốc "không chứa natri".
10. Quá liều
Trong các nghiên cứu lâm sàng đã có một số ít bệnh nhân dùng Tagrisso liều hàng ngày lên đến 240 mg mà không ghi nhận độc tính giới hạn liều (dose limiting toxicities). Trên các nghiên cứu này, bệnh nhân dùng Tagrisso với liều hàng ngày 160 mg và 240 mg đã ghi nhận có sự tăng tần suất và mức độ trầm trọng các phản ứng ngoại ý điển hình gây ra do EGFR TKI (chủ yếu là tiêu chảy và nổi mẩn da) so với mức liều 80 mg. Rất ít kinh nghiệm về quá liều ngẫu nhiên trên người. Tất cả các trường hợp đều xảy ra riêng lẻ là do bệnh nhân sai sót khi dùng thuốc mà không gặp bất kỳ hậu quả lâm sàng nào.
Không có xử trí đặc biệt trong trường hợp quá liều Tagrisso. Khi nghi ngờ quá liều, n&ec